January 7, 2026, JST
製薬業界におけるデータインテグリティ対応の取り組みについて
H. Kurumatani
keywords:
医薬品製造
,
データインテグリティ
医薬品製造に携わる事業では,医薬品の安全性を保証するために高い信頼性を有する製造記録の管理・運用が求められます。
記録の効率化や正確性の向上,および人為的過誤の防止のためには電子記録が広く活用されていますが,電子記録の正当性を保証する要件として "FDA 21 CFR Part 11, Electronic Records; Electronic Signatures"や"PIC/S GMP Annex 11",その記録内容の信頼性を保証するデータインテグリティの包括的なガイドラインとしてALCOA+原則が規定されています。
これらが補完的に作用することで電子記録の完全性と正当性が維持されており,医薬品製造装置を提供する際には上記の規定に準拠する装置を設計することが責務であると考えられます。
以下では我々のシステム設計の取り組みについて紹介します。
ALCOA+原則
医薬品の安全性を保証することを目的として,製造工程の記録の完全性を保証するためにALCOA+原則に準拠した管理が求められています。
- A: Attributable (帰属性)
- 装置の動作,作業員の操作が追跡・特定可能であること
- 装置制御システムのロギングトレース,HMIの監査証跡,電子署名による責任所在の明確化等を実施すること
- L: Legible (判読性)
- 記録の判読性を確保すること
- C: Contemporaneous (同時性)
- 事象の発生時点で記録をすること
- O: Original (原本性)
- 最初に記録されたデータを一貫して維持し,保存すること
- A: Accurate (正確性)
- 記録内容が正確であること
- 外部からの攻撃や内部不正(製造不正)によって不正なデータの記録を防ぐ仕組みを有すること
- C: Complete (完全性)
- 事象の再現性を確保するために記録すべき事柄が,見逃しなく全て記録されること
- 同時性(時刻の正確性)・正確性(内容の正確性)と合わせて,帰属性および一貫性の確立を保証すること
- C: Consistent (一貫性)
- 記録に矛盾がないこと
- E: Enduring (永続性)
- 記録が保存期間以内において「保護された状態」を維持すること
- 記録媒体の故障,外部からの攻撃,内部不正(記録改竄)等に対する耐障害性を有する記録システムを設置すること
- A: Available (可用性)
- 記録に即座にアクセスできること
- 判読性と合わせて,必要に応じて判読性の高い記録を即座に提供する体制を維持すること
以上の要件を満たすためには,以下の様なシステムが考えられます。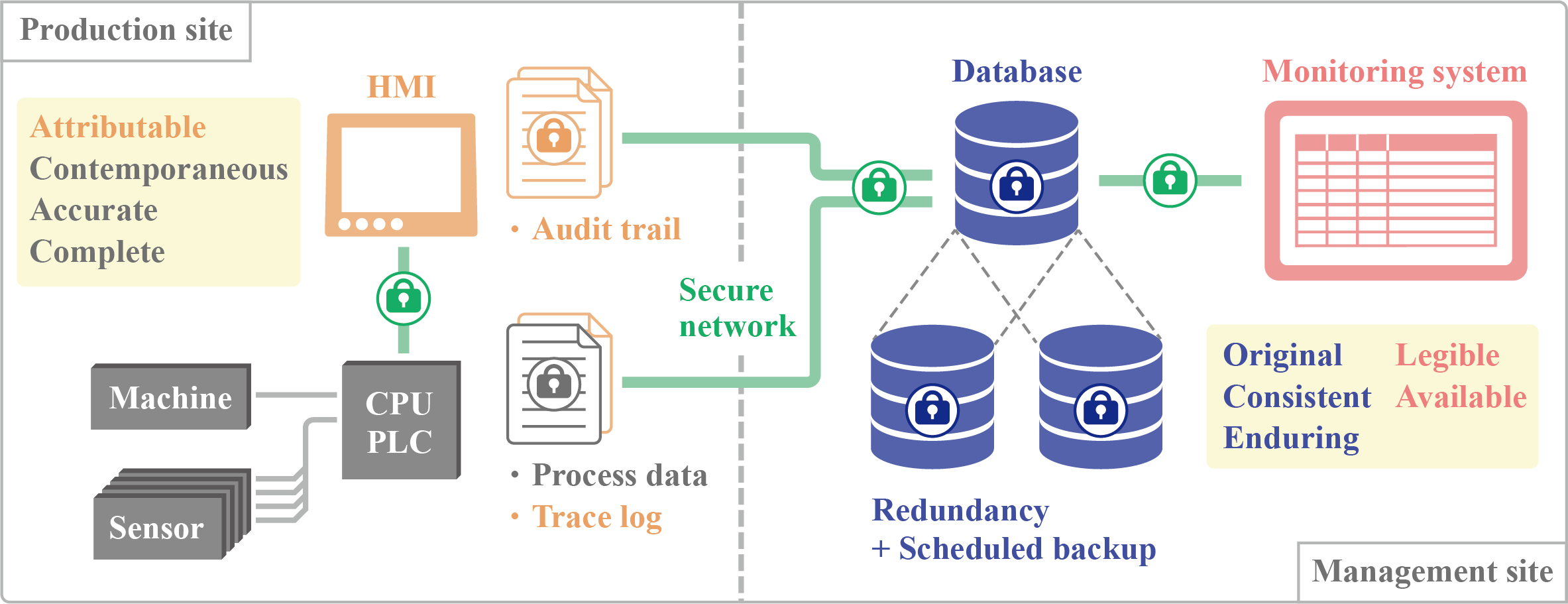 こちらの図では,データの完全性(同時性,正確性を含む)と帰属性の記録については現場レベルで行い,データの管理・運用は管理レベルで行うことを示しています。外部からの攻撃による記録盗聴・システム停止や内部からの記録改竄を防ぐため,システムを繋ぐネットワークはセキュアな方式を採用します。このネットワークとしては,中間者攻撃やなりすましを防ぐためにパケットレベルで認証・暗号化機能を備えていることが望ましく,さらには不明な機器からの接続を遮断する,不要なEthernetポートを物理的に使用不可能にする等の対策を施す必要があります。
こちらの図では,データの完全性(同時性,正確性を含む)と帰属性の記録については現場レベルで行い,データの管理・運用は管理レベルで行うことを示しています。外部からの攻撃による記録盗聴・システム停止や内部からの記録改竄を防ぐため,システムを繋ぐネットワークはセキュアな方式を採用します。このネットワークとしては,中間者攻撃やなりすましを防ぐためにパケットレベルで認証・暗号化機能を備えていることが望ましく,さらには不明な機器からの接続を遮断する,不要なEthernetポートを物理的に使用不可能にする等の対策を施す必要があります。

以下ではデータの流れについて確認します。
製造現場で発生するデータは,主に生産に関連するプロセスデータ,装置の動作記録,装置の操作記録を含む監査証跡となります。
これらが不正な操作によって正確性を失うことなく記録されるために,不正操作を許容しない装置設計とデータ改竄を許容しないネットワーク設計が必要となります。
これにより,帰属性を確保した完全なデータを管理レベルに届けることができます。
管理レベルでの責務は,届いたデータの堅牢な保護(永続性)と運用(判読性・可用性)となります。
これを実現するため,データベースおよびその管理システムを導入することで対応しています。
データベース管理システムを運用することでアクセス認証やデータバックアップ,効率的な検索等の機能を使用することができ,データの保護および安全な運用を促進します。
このようなデータの一元管理により,生産工程の管理や分析等のデータ活用も可能です。
また,記憶媒体の故障に際してデータの損失を防ぐため,RAID(Redundant Arrays of Inexpensive Disks)と呼ばれる記憶媒体の冗長化とデータ復旧体制の整備も行なっています。
FDA 21 CFR Part 11
本規制はコンピュータシステムの普及による電子記録・電子署名の使用に対する需要に応えて,電子記録に紙記録や手書き署名と同等の信頼性・信頼性を与えるための要件です。電子化の要望が上がった当初,電子記録は紙記録と比較して改竄や削除が容易に行えたため,電子記録が信頼に足るものであることを保証する基準として本規制が設けられました。また,1980年代から1990年代に発生した製造不正と偽造報告の影響を受け,監査証跡記録の保管や電子署名による責任所在の明確化などの規制要件が含まれています。
本規制はデータの真正性に重点を置いており,前提としてALCOA+原則に準拠した記録管理を行う必要があります。
その上で,本規制はデータに対するアクセス権限の制御と運用を求めています。
"Subpart B-Electronic Records, §11.10 Controls for closed systems" では,電子記録の内容に責任を有する作業者が電子記録の真正性・完全性・機密性を確保し,署名された記録が真正であることを証明するための手続きと管理方法が記載されています。
この項目にはデータ完全性の他に運用上の要件が求められており,装置のシステム設計に関連する要件として以下が挙げられます。
- (d) システムへのアクセスを許可された者のみに限定すること
- (e) 作業者による電子記録の作成・変更・削除に関する監査証跡を記録すること
- (f) 作業者が製造手順書に従っていることを適宜確認すること
- (g) 認証機能を用いてシステム/入出力デバイスへのアクセス,電子記録への電子署名を制限すること
- (h) データ入力や操作指示の有効性を判定するため,装置の正常性を適宜確認すること。
(d), (g) はアクセス権限に関する要件,(e) は監査証跡の内容に関する要件,(f) はシステムのユーザインタフェースに関する要件,(h) はシステムを動作させるデバイスに対する要件となっています。
電子署名については,現状対応予定はありません。
アクセス権限の管理については資格情報による認証を使用しており,資格の設定・変更には "Subpart C-Electronic Signatures, §11.200 Electronic signature components and controls / §11.300 Controls for identification codes/passwords." に記載される要件に準拠しています。
以上の基本設計を踏まえ,お客様の要求仕様に応えるよう機能追加・修正を実施します。